Periyodik tablo, tanımlanan tüm elementlerin sıralı bir sistemidir. Bu elementler evrenimizdeki her şeyi oluşturur. Periyodik tablonun kimyasal elementleri doğadaki her şeyin yapı taşlarıdır.
Bu unsurlar aynı zamanda modern toplumları sayısız şekilde şekillendiren ürünleri ve teknolojileri de yaratır. Ayrıca bunlar temiz içme suyu, ilaçlar ve güneş panellerinden elektronik bileşenlere kadar uzanan teknolojilerdir.
Periyodik Tablo ya da Cetvel Nedir?
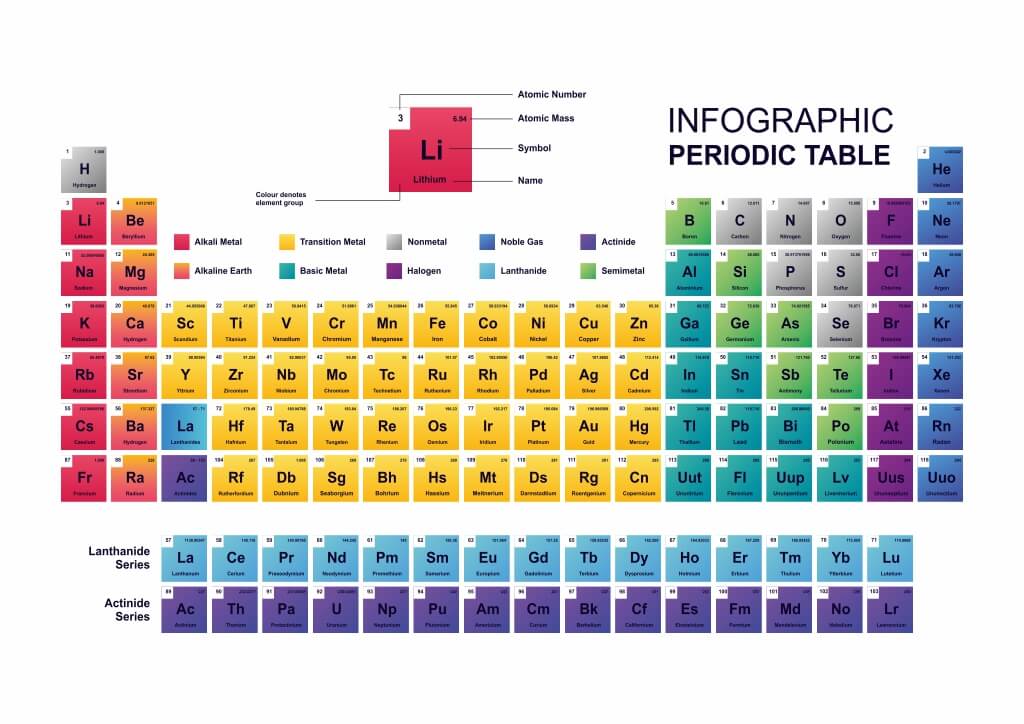
Periyodik tablo, elementlerin periyodik olarak düzenlenmiş bir şekilde sıralandığı bir tablo veya grafiktir. Periyodik cetvel, elementlerin atomik numaralarının büyüklüklerine göre sıralanır ve aynı atomik numarasına sahip elementler aynı gruplarda yer alır. Tablo, elementlerin fiziksel ve kimyasal özelliklerini karşılaştırmak için kullanılır. Bu özellikler, elementlerin atomik numaraları, atom çekirdeklerinde bulunan proton ve nötron sayıları, valans elektronları ve çeşitli diğer özelliklerdir.
Periyodik tablo, insanoğlunun bildiği tüm elementlerin artan atom numaralarına ve tekrarlayan kimyasal özelliklerine göre düzenlenmesidir. Bir satırın bir nokta ve bir sütunun bir grup olduğu bir tablo düzenlemesinde sıralanırlar. Elementler artan atom numaralarına göre soldan sağa ve yukarıdan aşağıya doğru sıralanır. Aynı gruptaki elementler aynı değerlik elektron konfigürasyonuna ve dolayısıyla benzer kimyasal özelliklere sahip olacaktır.
Oysa aynı periyottaki elementler artan bir değerlik elektronlarına sahip olacaktır. Dolayısıyla atomun enerji seviyesi arttıkça, enerji seviyesi başına enerji alt seviyelerinin sayısı da artar. Periyodik tablonun ilk 94 elementi doğal olarak oluşurken, 95’ten 118’e kadar olan elementler sadece laboratuvarlarda veya nükleer reaktörlerde sentezlenmiştir. Son olarak periyodik tablo, periyodik çizelge, periyodik cetvel ve elementler tablosu gibi birçok farklı şekilde adlandırılmaktadır.
Periyodik Tablo Özellikleri
Periyodik tablo, elementlerin fiziksel ve kimyasal özelliklerini karşılaştırmak için kullanılır. Örneğin, demir ve çinko gibi elementler, atomik yapıları ve kimyasal özellikleri benzer olduğu için aynı grupta yer alır. Aynı zamanda, demir ve çinko gibi elementler, atom ağırlıkları benzer olduğu için aynı periyotta yer alır.
Bu sayede, periyodik tablo, elementlerin fiziksel ve kimyasal özelliklerini karşılaştırmak için kullanılır. Periyodik tablo, elementlerin atomik numaralarının büyüklüklerine göre sıralanır ve aynı atomik numarasına sahip elementler aynı gruplarda yer alır. Periyodik tablo aşağıdaki özellikleri içerir:
- Atomik Numaraları
- Simge
- Atom Ağırlığı
- Atom Yapısı
- Kimyasal Özellikler
- Fiziksel Özellikler
- Gruplar
- Periyotlar
Atomik Numaraları
Elementlerin atomik numaraları, atom çekirdeklerinde bulunan proton sayısına göre verilir. Bu sayı, elementin periyodik tablo sırasını belirler.
Simge
Elementlerin simgeleri, elementlerin adlarının kısaltılmış halidir. Örneğin, Hidrojen elementinin simgesi H, Demir elementinin simgesi Fe’dir.
Atom Ağırlığı
Elementlerin atom ağırlıkları, atom çekirdeklerinde bulunan proton ve nötronların ağırlıklarının toplamıdır. Atom ağırlığı, elementlerin periyodik tablo sıralamasını etkileyebilir.
Atom Yapısı
Elementlerin atom yapıları, atom çekirdeklerinde bulunan proton ve nötronların sayıları ve yapıları ile valans elektronlarının sayısı ve yapılarına göre belirlenir. Atom yapısı, elementlerin kimyasal özelliklerini belirler.
Kimyasal Özellikler
Elementlerin kimyasal özellikleri, atom yapısına göre belirlenir. Örneğin, hidrojen ve oksijen gazlarının birleşimiyle su oluşur. Bu özellik, periyodik tablo içinde elementlerin sınıflandırılmasına yardımcı olur.
Fiziksel Özellikler
Elementlerin fiziksel özellikleri, atomik yapılarına göre belirlenir. Örneğin, demir elementi, sıcaklık arttıkça eriyik bir metal olup, donma noktası 1535°C’dir. Bu özellik, periyodik tablo içinde elementlerin sınıflandırılmasına yardımcı olur.
Gruplar
Elementler, atomik numaralarına göre gruplara ayrılır. Gruplar, periyodik tablonun sütunlarını oluşturur. Grupların sayısı ve elementlerin sıralaması, elementlerin atomik yapılarına göre belirlenir. Gruplar içinde bulunan elementlerin kimyasal özellikleri benzerdir.
Periyotlar
Elementler, grupların altında bulunan satırlara periyotlar olarak sıralanır. Periyotlar, elementlerin atomik yapılarına göre belirlenir. Periyotlar içinde bulunan elementlerin kimyasal özellikleri benzerdir.
Periyodik Tablonun Tarihçesi

Periyodik tablo birçokları için kimyanın sembolüdür. Bu, evrendeki bilinen tüm elementleri kolayca okunabilen bir tabloda bir araya getiren tek bir görüntüdür. Bu elementler fikri ilk olarak MÖ 300’de ortaya çıktı. Büyük Yunan ünlü filozof Aristoteles, dünyadaki her şeyin bu elementlerden oluştuğu fikrini tasarladı. Antik çağda altın ve gümüş gibi elementlere kolayca erişilebilirdi, ancak Aristoteles’in seçtiği elementler Toprak, Su, Ateş ve Hava idi. Aşağıda geçmişten günümüze periyodik tablo tarihi ile ilgili kapsamlı bir rehber bulabilirsiniz.
John Newlands ve Alexandre-Emile Béguyer de Chancourtois gibi bilim adamları kendi periyodik tablo versiyonlarını oluşturdular. Bu sürümler nispeten basitti ve aynı zamanda biraz belirsiz ve okunması zordu. Hepsini bir araya getiren bilim adamı Dmitri Mendeleev‘di. Mendeleev, Rus doğumlu bir kimyagerdi ve periyodik tablonun modern bir versiyonunu ilk yayınlayan kişiydi. Ayrıca tablosu, elementleri atom ağırlıklarına (molar kütlelere) göre sıraladı. Elementler atom ağırlıklarına göre sıralandığında benzer kimyasal özellikler sergilediler.
Sir William Ramsay soy gazları ekledi ve Henry Mosley bir elementin atom numarasını nicel olarak bulmanın bir yolunu keşfetti ve Mendeleev’in tablosunun etrafındaki atom numarasına göre düzenlenecek sırayı değiştirdi. Son olarak, 1945’te Manhattan Projesi birçok yeni radyoaktif elementin keşfini sağladı. Glenn T. Seaborg, tablonun altındaki aktinit ve lantanit serilerinin eklenmesi şeklinde bir tablo değişikliği önerdi. Bu fikir, Americium ve Curium’un ve benzersiz özelliklerinin keşfiyle ortaya çıktı. Değişiklik ilk başta kabul edilmedi, ancak şimdi tüm periyodik tablolarda yer alıyor.
Hennig Brand – 1649
1649’da Hennig Brand fosfor’u ilk keşfeden kişi olduğunda elementler dünyası için büyük bir adım attı. Brand, Felsefe Taşı’nı veya herhangi bir sıradan metali altına çevirecek bir nesneyi arayan bir simyacıydı. Aramasında insan idrarını damıtmak dahil her şeyi denedi. Bu deney yapıldığında Brand parlayan beyaz bir kaya buldu. Bu, Fosfor adını verdiği yeni elementti. Aydınlanma döneminin simyacıları ve bilim adamları, elementler hakkındaki fikirlere inanılmaz miktarda bilgi eklediler.
Antoine Lavoisier – 1789
Şimdi ‘modern kimyanın babası‘ olarak bilinen Antoine Lavoisier, 33 element veya kendi deyimiyle “basit maddeler”den oluşan bir liste yayınlıyor. Listesi, ısı ve ışık gibi şeyleri içermesine rağmen, elementler hakkında önceki düşüncelerden büyük bir ayrılmadır. Lavoisier için bir element, kimyasal ayrışmanın son aşamasını temsil eder. Bu görüş, elementlerin doğası hakkında daha önceki metafizik kavramlardan uzaklaşır ve neyin gözlemlenip ölçülebileceğini vurgular.
John Dalton – 1805
Manchester’da bir öğretmen ve Quaker olan John Dalton, antik Yunan filozoflarının atom teorisini nicel hale getirirken yeniden canlandırıyor. Dalton ayrıca yeni bir element listesi sağlar, ancak onunki, bir birim ağırlık atanan bir hidrojen atomuna kıyasla her bir elementin atomlarının nispi ağırlıklarını içerir. Bu gelişme, diğer kimyagerlerin farklı elementler arasındaki ilişkileri ayırt etmeye başlayabilecekleri bir temel sağlar ve periyodik tablonun gelişiminde önemli bir adımdır.
Wolfgang Döbereiner – 1829
Almanya’nın Jena kentinde çalışan bir kimyager olan Wolfgang Döbereiner, üç elementten oluşan birkaç grup arasındaki ilişkiler olan üçlüleri keşfetmek için John Dalton’un atom ağırlıklarından yararlanır. Örneğin, bir sodyum atomu, ortalama lityum ve potasyum ağırlıklarıyla yaklaşık olarak aynı ağırlığa sahiptir. Ayrıca, sodyumun kimyasal reaktivitesi, lityum ve potasyumun ortalamasıdır. Böylece üçlüler, kimyasal periyodikliğin keşfinin bir habercisi olarak, farklı elementler arasındaki matematiksel ilişkilere işaret eder.
Alexandre-Emile Béguyer De Chancourtois – 1862-1867
Yaklaşık beş yıllık bir süre boyunca, birden fazla bilim adamı bağımsız olarak periyodik tablonun önemli öncülerini geliştirir. İlki, elementleri artan atom ağırlığına göre sıralayan Fransız jeolog Alexandre-Emile Béguyer De Chancourtois. Bu çizgi daha sonra metal bir silindirin etrafında sarmal bir şekilde düzenlenir, böylece benzer elemanlar silindirin uzunluğu boyunca çizilen dikey çizgiler boyunca düşer. Kısa bir süre sonra, İngiltere’de bağımsız olarak çalışan John Alexander Reina Newlands ve William Odling, Amerika Birleşik Devletleri’nde çalışan Danimarkalı bir sürgün olan Gustavus Heinrichs’in yaptığı gibi iki boyutlu periyodik tablolar yayınlar. Bu sistemlerin hiçbiri hem bilimsel hem de sosyolojik çeşitli nedenlerle fazla itibar görmez.
Julius Lothar Meyer – 1868
Alman kimyager Julius Lothar Meyer, tamamen olgun bir tablo sisteminin keşfini temsil eden bir dizi periyodik tablo yayınlar. Bununla birlikte, o zamanlar bilinen 60’tan fazla öğenin çoğunu başarılı bir şekilde barındırmasına rağmen, Lothar Meyer bir istisna dışında herhangi bir yeni veya eksik öğeyi tahmin edemez. 44.55 atom ağırlığına sahip olacağına inandığı tek bir elementin varlığı için geçici bir tahminde bulundu. Bu element sonunda İsveç’te keşfedilecek ve skandiyum olarak adlandırılacaktı. İlk ölçüldüğünde ağırlığı 44.6 idi.
Dmitri Mendeleev – 1869

Periyodik tablo, Rusya’nın St. Petersburg kentinde çalışan doğuştan bir Sibiryalı olan Dmitri Mendeleev tarafından 1869 yılında yayınlanmıştır. Mendeleev, elementlerin atomik numaralarına göre sıralamış ve aynı atomik numarasına sahip elementleri aynı sütunlarda toplamıştır. Bu sayede, elementlerin fiziksel ve kimyasal özellikleri arasında benzerlikler ve farklılıklar gösterirler.
Mendeleev, periyodik tablosunu yayınlamasından önce de elementlerin sınıflandırılması üzerine çalışmalar yapmıştı. Ancak, Mendeleev’in periyodik tablosu, diğer elementlerin sınıflandırma çalışmalarından daha başarılı olmuş ve bugün hala kimya ve fizik öğreniminde önemli bir araç olarak kullanılmaktadır.
Periyodik tablo, Mendeleev tarafından yayınlandıktan sonra da çeşitli değişiklikler ve güncellemeler yapılmıştır. Örneğin, tablo içinde yeni keşfedilen elementler eklenmiş, atom çekirdeklerinde bulunan proton ve nötron sayıları göz önüne alınarak düzenlemeler yapılmıştır. Bu sayede, periyodik tablo bugünkü haline gelmiştir.
Kimyasal İncelemeler – 1894
Halojen kimyası, çeşitli kimyasalların, farmasötiklerin ve polimerlerin üretiminde merkezi bir rol oynar ve doğal gazın iyileştirilmesinde potansiyel uygulamalara sahiptir. Kapalı bir halojen döngüye sahip olmak, bu süreçlerin verimli ve sürdürülebilir bir şekilde çalışmasına olanak tanır. Bu amaçla, uygun heterojen katalizörlerin tasarımı kilit öneme sahiptir.
X-ışınları – 1895-1897
Art arda üç yıl içinde, elementlerin, periyodik tablonun ve genel olarak kimyanın incelenmesi üzerinde derin bir etkisi olan X-ışınları, radyoaktivite ve elektron keşfedildi. X-ışınları, her bir elementi kesin olarak tanımlamak için deneysel bir yönteme yol açar. Radyoaktivite ve elektron keşifleri, atomların Dalton’un zannettiği gibi bölünemez değil, bir alt yapıya sahip olduğunu gösteriyor. 1900’de Max Planck kuantum eylemini tanıttı. Bu keşifler birlikte kısa sürede elementlerin neden periyodik tablodaki gruplar ayrıldığını açıklayacaktır.
Niels Bohr – 1913-1914
1913’te Kopenhag’da çalışan Niels Bohr, belirli elementlerin periyodik tabloda neden belirli gruplara ayrıldığına dair ilk açıklamayı yayınladı. Bu özellik, bir atomun çekirdeği etrafındaki eşmerkezli kabuklardaki benzer elektron düzenlemeleri nedeniyle ortaya çıkar. 1913 ve 1914 arasında, Manchester ve daha sonra Oxford’da bulunan Henry Moseley, deneysel olarak, elementlerin daha sonra “atom numarası” olarak adlandırılan bir sıra numarasına göre sıralandığını, şimdiye kadar gelenek olduğu gibi atom ağırlığına göre sıralandığından daha doğru bir şekilde sıralandığını tespit etti. bu nokta. Moseley’in yöntemi ayrıca, herhangi bir belirli elementi benzersiz bir şekilde tanımlamanın yanı sıra, hidrojen (Z = 1) ve uranyumdan (Z = 92) doğal olarak oluşan elementler arasında keşfedilmeyi bekleyen elementlerin sayısını belirtmenin yollarını da sağlar.
Emilio Segrè – 1937
Yapay olarak üretilen ilk element, Emilio Segrè ve çalışma arkadaşları tarafından Sicilya, Palermo’da keşfedildi. Bu element, analiz için İtalya’ya gönderilmeden önce, Segrè’nin çalıştığı Berkeley’deki California Üniversitesi’ndeki bir parçacık hızlandırıcıda sentezlenmişti. Bu, 26 transuranik elemente ek olarak, prometyum (Z = 61) ve astatin (Z = 85) dahil olmak üzere, şu anda yapay olarak üretilen yaklaşık 30 elementin ilki olacaktı. Bu tür elementlerin en son keşifleri nihonium (Z = 103), moscovium (Z = 105), tennessin (Z = 117) ve oganesson’dur (Z = 118).
McMillan ve Philip Hauge Abelson – 1939
Edwin Mattison McMillan ve Philip Hauge Abelson tarafından California Üniversitesi, Berkeley’de sentezlenen ilk transuranik element, neptünyumdur. Bunu aynı laboratuvarda 1941 yılında Glenn T. Seaborg tarafından plütonyum sentezi takip eder. Seaborg, onuruna seaborgium olarak adlandırılan element 106 da dahil olmak üzere toplam 10 bu tür transuranik elementin sentezine katkıda bulunacaktır. Ayrıca periyodik tabloda, aktinitleri d-blok elemanlarından ziyade f-blokunun bir parçası olarak gösteren bir değişiklik önerecekti. Benzer düzenlemeler daha önce bağımsız olarak Alfred Werner ve Charles Janet tarafından önerildi.
Yakın Tarih – 2019
Periyodik tablo hiçbir şekilde kapalı bir konu değildir. Keşfinden bu yana ilk kez şimdi tamamlanmış olmasına rağmen, 119 ve 120 numaralı elementleri sentezleme girişimleri aktif olarak sürdürülmektedir. Eğer keşfedilirse, bu elementler yeni bir sekizinci dönemin başlangıcını oluşturacaktı. Buna ek olarak, grup 3’ün bileşimi de dahil olmak üzere çeşitli elementlerin yerleştirilmesi ve periyodik tablonun optimal bir formunun olup olmadığı konusunda tartışmalar devam etmektedir. Bu rolü doldurmak için iyi bir aday, Charles Janet’in geleneksel tablodan daha fazla düzenlilik gösteren ve ayrıca periyodik sistemin varsayılan kuantum mekanik temelleriyle daha uyumlu olan sol adım tablosu olabilir.
Periyodik Tablo Neden Önemli?

Periyodik tablo, herhangi bir okul öğrencisinin veya bilim insanının hayatında önemli bir araçtır. Büyük bir bilgi sistemini çok kullanışlı bir araç olarak kategorize edip organize etmek, yıllarca süren çalışmaların muazzam bir başarısıdır. Ayrıca dünya çapında evrensel olarak tanınmakta ve ülkeler arasında kolayca çevrilebilmektedir. Asıl önemi tarihte, Mendeleev tarafından bırakılan ve bilim adamlarını günlük hayatımızda geniş kullanımları olan yeni ve heyecan verici unsurları keşfetmeye yönlendiren boşlukların araştırılmasını desteklemek için kullanıldığı yerde yatmaktadır.
O olmasaydı, kanıksadığımız birçok metal ve faydalı element asla keşfedilemezdi. Örneğin, büyük ilaç şirketleri, hükümetler ve üniversiteler tarafından her gün devasa araştırma projeleri yürütülmektedir. Bu projeler birkaç kıtada, birkaç dilde ve farklı laboratuvarlarda gerçekleştirilebilir, ancak hepsi periyodik tablonun ortak dili ve onun oluşumunu destekleyen bilim tarafından bir arada tutulur.
Periyodik Tablo Grupları

Modern periyodik tabloda grup olarak bilinen, soldan sağa doğru dizilmiş on sekiz dikey sütun ve periyot olarak bilinen yedi yatay sıra vardır. Ayrıca periyodik tabloda 8 A grubu ve 10 B grubu vardır. A Grubu elemanlara ana grup elemanları da denir. Tüm B grubu elementler metaldir. Ayrıca B grubu elementlere geçiş metalleri de denir. B Grubu 2A grubu ile 3A grubu arasında yer alır.
Periyodik Tabloda Kaç Grup Vardır?
Periyodik tabloda her sütunda bir tane olmak üzere 18 grup vardır. Soldaki ilk sütun grup 1’dir ve sağdaki son sütun grup 18’dir.
| Grup Numaraları | Grup İsmi | Grup Özellikleri |
| Grup 1 – 1A | Alkali Metaller | Su ile güçlü alkaliler oluştururlar. |
| Grup 2 – 2A | Alkali Toprak Metaller | Alkali oluştururlar ancak grup 1 elementlerinden daha zayıftırlar. |
| Grup 13 – 3A | Bor Ailesi | Bor bu ailenin ilk üyesidir. |
| Grup 14 – 4A | Karbon Ailesi | Carbon bu ailenin ilk üyesidir. |
| Grup 15 – 5A | Azot Ailesi | Bu grupta ametaller ve metaloidler bulunur. |
| Grup 16 – 6A | Oksijen Ailesi | Kalkojenler olarak da bilinirler. |
| Grup 17 – 7A | Halojen Ailesi | Bu grubun elementleri tuzları oluşturur. |
| Grup 18 – 8A | Soygazlar | Soy gazlardır ve normal şartlar altında inerttirler. |
Periyodik Tablo Elementler ve İsimleri

Aşağıda bulunan periyodik tablo çizelgesi, hızlı ve basit referans için element sembolü, atom numarası ve Pauling elektronegatiflik değeri dahil olmak üzere elementleri alfabetik sırayla ada göre listeler. Aşağıdaki element tablosu alfabetik sıraya göre dizilmiştir. Ayrıca periyodik tablo element isimleri, sembolleri, atom numaraları ve elektronegatiflik değerleri verilmiştir.
| Element İsimleri | Sembol | Atom Numarası | Elektronegatiflik (χ) |
| Aktinyum | Ac | 89 | 1.1 |
| Alüminyum | Al | 13 | 1.61 |
| Amerikyum | Am | 95 | 1.3 |
| Antimon | Sb | 51 | 2.05 |
| Argon | Ar | 18 | |
| Arsenik | As | 33 | 2.18 |
| Astatine | At | 85 | 2.2 |
| Aynştaynyum | Es | 99 | 1.3 |
| Azot | N | 7 | 3.04 |
| Bakır | Cu | 29 | 1.9 |
| Baryum | Ba | 56 | 0.89 |
| Berilyum | Be | 4 | 1.57 |
| Berkelyum | Bk | 97 | 1.3 |
| Bizmut | Bi | 83 | 2.02 |
| Bohriyum | Bh | 107 | |
| Bor | B | 5 | 2.04 |
| Brom | Br | 35 | 2.96 |
| Cıva | Hg | 80 | 2 |
| Darmstadyum | Ds | 110 | |
| Demir | Fe | 26 | 1.83 |
| Disprosyum | Dy | 66 | 1.22 |
| Dubniyum | Db | 105 | |
| Erbiyum | Er | 68 | 1.24 |
| Evropiyum | Eu | 63 | |
| Fermiyum | Fm | 100 | 1.3 |
| Flor | F | 9 | 3.98 |
| Fosfor | P | 15 | 2.19 |
| Fransiyum | Fr | 87 | 0.7 |
| Gadolinyum | Gd | 64 | 1.2 |
| Galyum | Ga | 31 | 1.81 |
| Germanyum | Ge | 32 | 2.01 |
| Gold | Au | 79 | 2.54 |
| Hafniyum | Hf | 72 | 1.3 |
| Hassiyum | Hs | 108 | |
| Helyum | He | 2 | |
| Hidrojen | H | 1 | 2.2 |
| Holmiyum | Ho | 67 | 1.23 |
| İndiyum | In | 49 | 1.78 |
| İridyum | Ir | 77 | 2.2 |
| İyot | I | 53 | 2.66 |
| Kadmiyum | Cd | 48 | 1.69 |
| Kaliforniyum | Cf | 98 | 1.3 |
| Kalsiyum | Ca | 20 | 1 |
| Karbon | C | 6 | 2.55 |
| Klor | Cl | 17 | 3.16 |
| Kobalt | Co | 27 | 1.88 |
| Kripton | Kr | 36 | 3 |
| Krom | Cr | 24 | 1.66 |
| Kurşun | Pb | 82 | 2.33 |
| Küriyum | Cm | 96 | 1.3 |
| Lantanyum | La | 57 | 1.1 |
| Lavrensiyum | Lr | 103 | |
| Lityum | Li | 3 | 0.98 |
| Lütesyum | Lu | 71 | 1.27 |
| Magnezyum | Mg | 12 | 1.31 |
| Manganez | Mn | 25 | 1.55 |
| Meitneryum | Mt | 109 | |
| Mendelevyum | Md | 101 | 1.3 |
| Molibdenyum | Mo | 42 | 2.16 |
| Neodimyum | Nd | 60 | 1.14 |
| Neon | Ne | 10 | |
| Neptünyum | Np | 93 | 1.36 |
| Nikel | Ni | 28 | 1.91 |
| Niyobyum | Nb | 41 | 1.6 |
| Nobelyum | No | 102 | 1.3 |
| Oganesson | Og | 118 | |
| Oksijen | O | 8 | 3.44 |
| Osmiyum | Os | 76 | 2.2 |
| Paladyum | Pd | 46 | 2.2 |
| Platinyum | Pt | 78 | 2.28 |
| Plütonyum | Pu | 94 | 1.28 |
| Polonyum | Po | 84 | 2 |
| Potasyum | K | 19 | 0.82 |
| Praseodim | Pr | 59 | 1.13 |
| Prometyum | Pm | 61 | |
| Protaktinyum | Pa | 91 | 1.5 |
| Radon | Rn | 86 | |
| Radyum | Ra | 88 | 0.9 |
| Renyum | Re | 75 | 1.9 |
| Rodyum | Rh | 45 | 2.28 |
| Röntgenyum | Rg | 111 | |
| Rubidyum | Rb | 37 | 0.82 |
| Rutenyum | Ru | 44 | 2.2 |
| Rutherfordyum | Rf | 104 | |
| Samaryum | Sm | 62 | 1.17 |
| Seryum | Ce | 58 | 1.12 |
| Sezyum | Cs | 55 | 0.79 |
Periyodik Tablo PDF İndir
PDF formatında yazdırılabilir periyodik tabloyu sizin için renkli ve eksiksiz olarak hazırladık. Hemen aşağıdaki bağlantıları kullanarak Türkçe ve İngilizce olarak indirebilirsiniz.
Periyodik Tablo Türkçe PDF
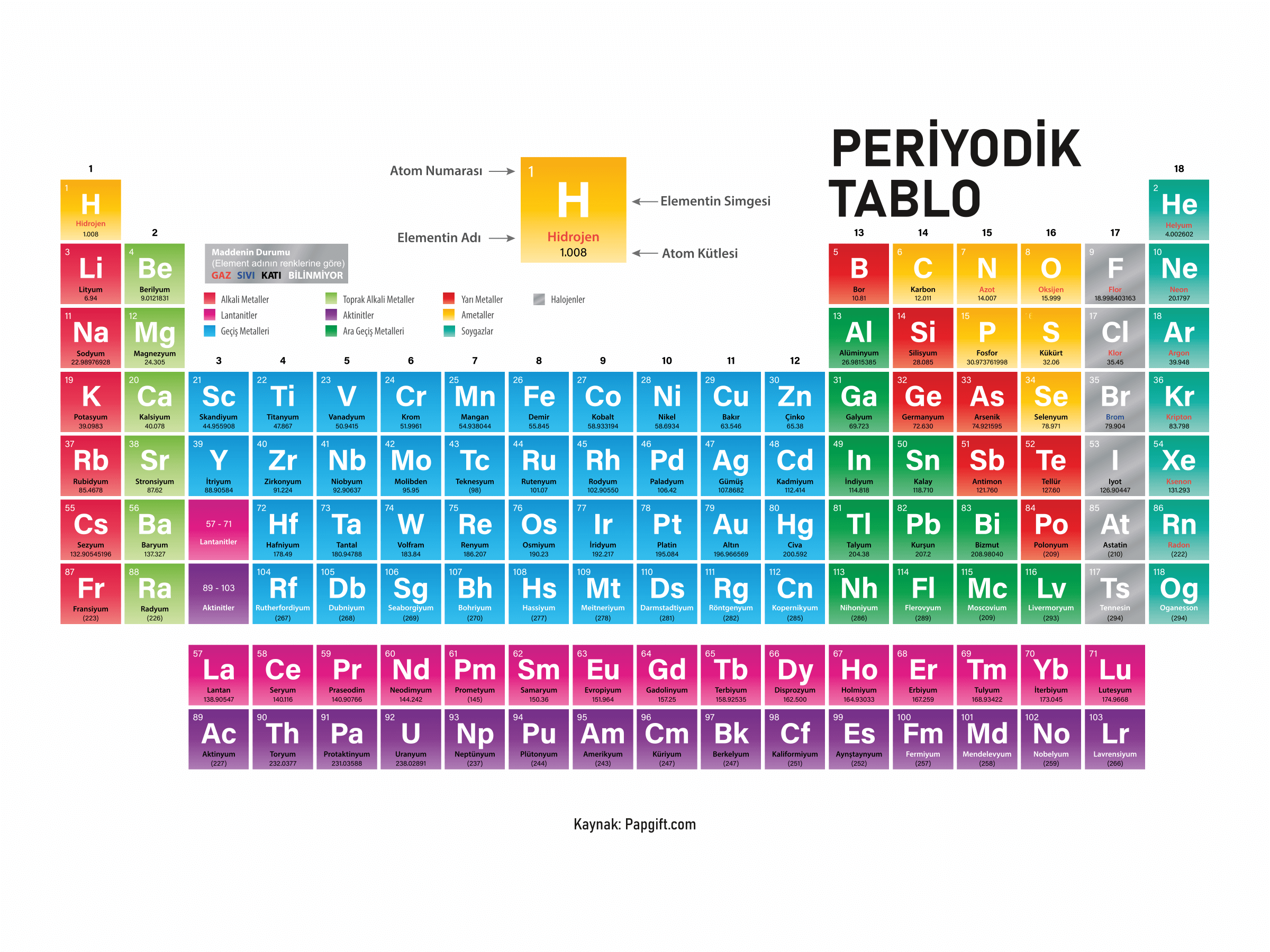
Bu renkli PDF türkçe periyodik tablo, yazdırma ve baskı için optimize edilmiştir. Ayrıca net bir yazı tipi ve yazıcı dostu renkler kullanılmıştır. 118 elementin tümü türkçe PDF içinde bulunabilir.
Periyodik Tablo İngilizce PDF
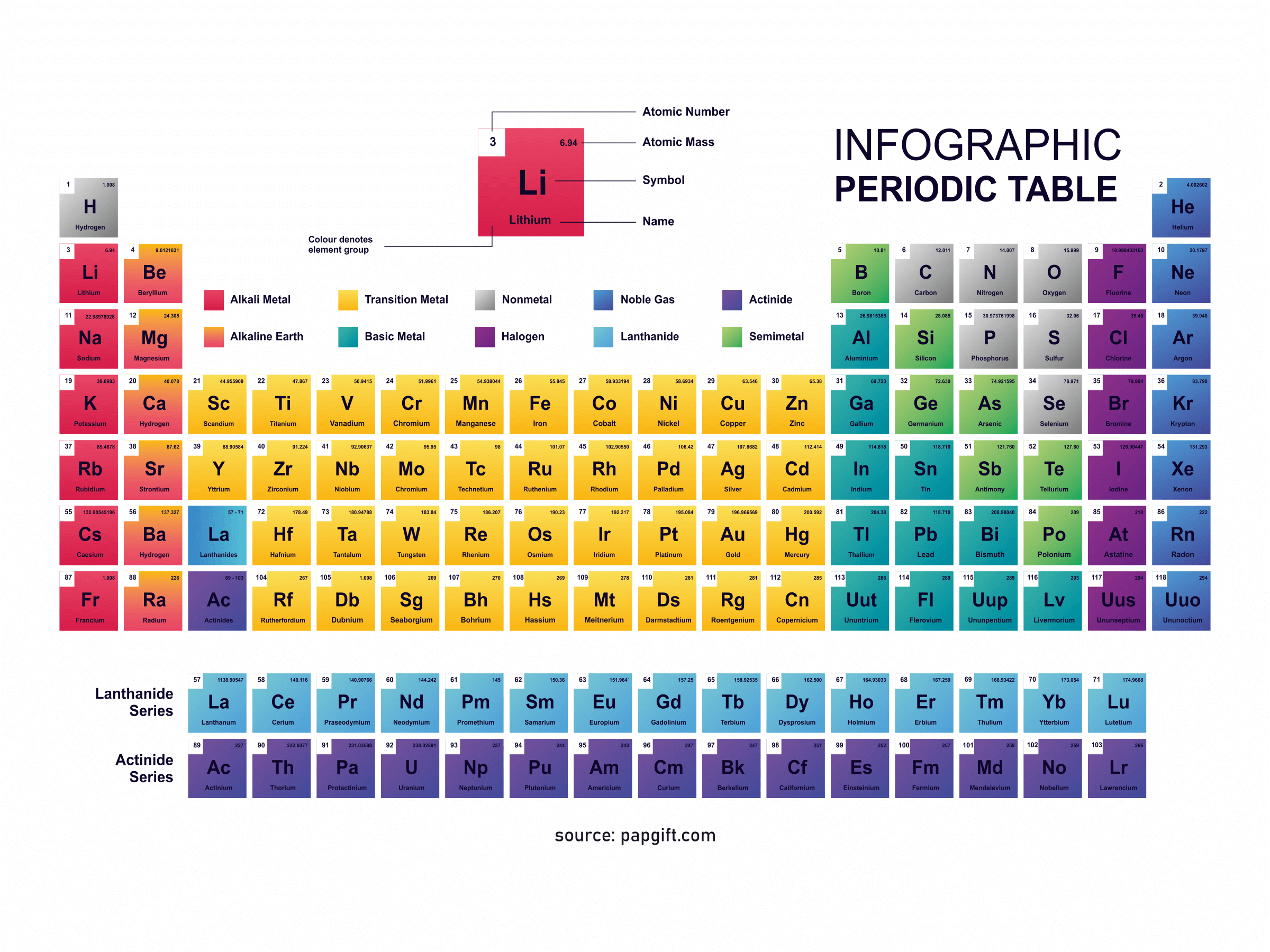
Renkli PDF ingilizce periyodik tablo, yazdırma ve baskı için optimize edilmiştir. Ayrıca net bir yazı tipi ve yazıcı dostu renkler kullanılmıştır. 118 elementin tümü ingilizce PDF içinde bulunabilir.











